Hoe is het periodiek systeem opgebouwd?
In het periodiek systeem der elementen (of kortweg periodiek systeem) zijn alle elementen gerangschikt naar opklimmend atoomnummer en overeenkomsten in chemische eigenschappen. In Binas-tabel 99 of op het schutblad van ScienceData staat een voorbeeld van het periodiek systeem.
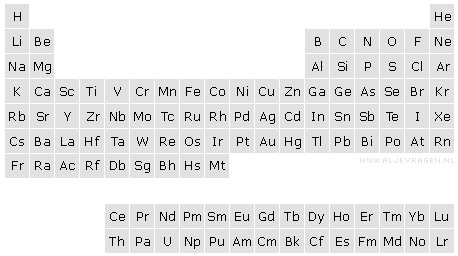
De elementen met atoomnummers 58 (Ce) tot en met 71 (Lu), de lantaniden, en 90 (Th) tot en met 103 (Lr), de actiniden, worden onderaan in aparte rijen geplaatst.
Periode
Een horizontale rij van elementen met toenemend atoomnummer wordt een periode genoemd. Er zijn in totaal 7 periodes.
Groep
Een verticale kolom van elementen die verwante eigenschappen vertonen wordt een groep genoemd. Er zijn in totaal 18 groepen.
Enkele belangrijke groepen zijn:
- Alkalimetalen (groep 1)
- Aardalkalimetalen (groep 2)
- Overgangsmetalen (groep 3 t/m 12)
- Halogenen (groep 17)
- Edelgassen (groep 18)
Metalen en niet-metalen
Een belangrijke onderverdeling van de elementen in het periodiek systeem is die in metalen en niet-metalen. In het periodiek systeem hieronder zie je hoe die onderverdeling is.
Merk op dat de meeste elementen tot de metalen worden gerekend.
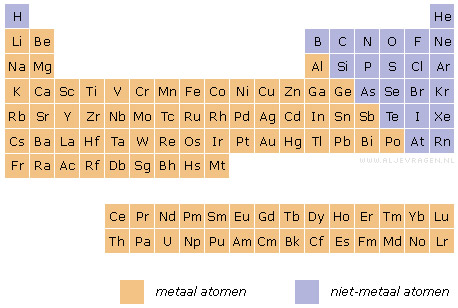
De diagonaal boor (B) - astaat (At) vormt de overgang tussen de metaal en niet-metaalatomen. Deze overgang is niet heel scherp. De elementen germanium (Ge) en antimoon (Sb) worden soms ook tot de niet-metaalatomen gerekend.