Wat wordt bedoeld met de edelheid van metalen?
De edelheid van metalen is niets anders dan een maat voor de reactiviteit van metalen met oxidatoren. Edele metalen reageren bijna niet, onedele metalen reageren wel.
Edele metalen
Voorbeelden zijn platina (Pt), goud (Au) en zilver (Ag).
Dit zijn de zwakste reductoren (zie Binas-tabel 48 of ScienceData-tabel 9.1f) en reageren dus niet of nauwelijks.
Halfedele metalen
Voorbeelden zijn koper (Cu) en kwik (Hg).
Deze metalen reageren niet met verdunde zuren of water maar wel met zuurstof.
Voorbeeld
2 Cu (s)+O2 (g)\(\longrightarrow\)2 CuO (s)
Onedele metalen
Voorbeelden zijn ijzer (Fe), zink (Zn), tin (Sn), lood (Pb), nikkel (Ni), chroom (Cr) en aluminium (Al).
Deze metalen zijn sterkere reductoren dan waterstofgas. Daardoor reageren ze, behalve met zuurstofgas, ook met verdunde zuren.
Voorbeeld
Zn (s)+2 H+ (aq)\(\longrightarrow\)Zn2++H2 (g)
Zeer onedele metalen
Voorbeelden zijn natrium (Na), lithium (Li), kalium (K), barium (Ba) en calcium (Ca).
Deze metalen zijn zulke sterke reductoren dat ze zelfs met de zeer zwakke oxidator water reageren.
Voorbeeld
2 Na (s)+2 H2O (l)\(\longrightarrow\)2 Na++2 OH− (aq)+H2 (g)
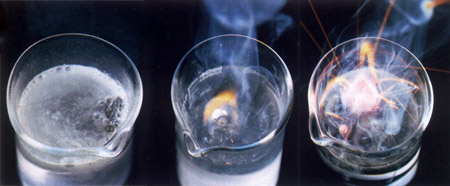 |
| De reactie van een aantal zeer onedele metalen met water. Lithium (links) reageert mild met water. Het ontstaan van waterstof is waar te nemen door het bubbelen van de oplossing. De reactie van natrium (midden) verloopt veel sneller en is zo exotherm dat het waterstof dat ontstaat direct vlam vat. Kalium (rechts) reageert bijna explosief met water. |