Wat is een moleculaire stof?
Moleculaire stoffen zijn stoffen die bestaan uit uitsluitend niet-metaalatomen. Moleculaire stoffen zijn opgebouwd uit moleculen.
Voorbeeld
De moleculaire stof water is opgebouwd uit moleculen water die ieder bestaan uit twee waterstofatomen en één zuurstofatoom.
Binding in moleculen
De atomen in een moleculaire stof zijn met elkaar verbonden door middel van atoombindingen (ook wel covalente bindingen genoemd). Een atoombinding wordt gevormd door een zogenoemd gemeenschappelijk elektronenpaar tussen de atomen: één elektron van een atoom vormt samen met één elektron van een ander atoom een elektronenpaar.
Formules
Er zijn verschillende manieren waarop je een moleculaire verbinding kunt aangeven. Je kunt dit doen door middel van een molecuulformule of een structuurformule.
Molecuulformule
De molecuulformule geeft het aantal van elke atoomsoort in een molecuul weer.
Voorbeelden
De molecuulformule van ammoniak is NH3 .
De molecuulformule van methaan is CH4 .
Structuurformule
De structuurformule geeft aan welke atomen aan elkaar verbonden zitten met atoombindingen.
Voorbeelden
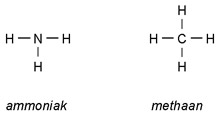
Binding tussen moleculen
De wijze waarop de moleculen in een moleculaire stof in vaste toestand gerangschikt zitten, noemen we het molecuulrooster.

De moleculen worden binnen het molecuulrooster door de volgende krachten bij elkaar gehouden:
1. vanderwaalsbinding - zwakke bindingssterkte
2. waterstofbruggen - matige bindingssterkte
3. dipool-dipoolbinding - zwakke bindingssterkte
Eigenschappen
Alle bindingen die in een moleculaire stof kunnen optreden (atoombinding, vanderwaalsbinding, waterstofbruggen en dipool-dipoolbinding) beïnvloeden de eigenschappen. Zo hebben moleculaire stoffen over het algemeen lage kook- en smeltpunten, geleiden ze geen stroom en is de oplosbaarheid afhankelijk van de polariteit.
Ruimtelijke bouw
Voor de duidelijkheid wordt in een structuurformule een molecuul weergegeven in een plat vlak. Maar hoe ziet een molecuul er ruimtelijk uit? Hiertoe 'vertalen' we een structuurformule naar een ruimtelijke structuur.
Er zijn een aantal punten om te onthouden:
1. Een dubbele of drievoudige binding tussen twee atomen ligt altijd op een rechte lijn.
2. Bijna alle atomen hebben een tetraëder omringing.
Voorbeeld
Methaan (CH4) neemt ruimtelijk gezien de vorm van een tetraëder aan.
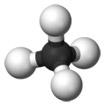
Voorbeeld
De structuurformule van koolstofdioxide (CO2) is O=C=O .
Omdat er een dubbele binding is tussen de beide zuurstofatomen en het koolstofatoom, ligt dit molecuul ruimtelijke gezien op een rechte lijn.
