Wat is een dipoolmoment?
Een dipoolmolecuul is een molecuul met polaire atoombindingen waarin het centrum van de positieve lading niet samenvalt met dat van de negatieve lading.
Een molecuul waarin een polaire atoombinding voorkomt heeft, door het verschil in elektronegativiteit tussen de atomen, een duidelijke positieve (δ+) en negatieve (δ−) kant. Een voorbeeld hiervan is een molecuul HCl:
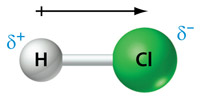
We zeggen ook wel dat zo'n molecuul een dipoolmoment heeft. In Binas-tabel 55 of ScienceData-tabel 8.8c staan de dipoolmomenten van enkele anorganische en organische stoffen vermeld.
Een dipoolmoment is een vectorgrootheid. Dit betekent dat het zowel een grootte als een richting heeft. Het wordt in een molecuul aangegeven met een pijl (zie de bovenstaande figuur) die wijst van het centrum van de δ+ naar het centrum van de δ−.
Meerdere polaire atoombindingen
Als we te maken hebben met een molecuul met meer dan één polaire atoombinding dan wordt het dipoolmoment van het molecuul gevonden door vectoriële optelling van de afzonderlijke vectoren. In de figuur hieronder is dat weergegeven voor een molecuul water. De twee afzonderlijke dipoolmomenten evenwijdig aan de atoombindingen geven bij optelling een netto dipoolmoment die wijst van links naar rechts:
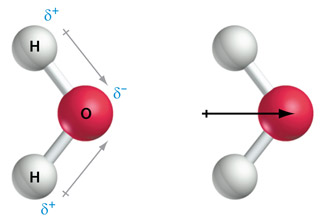
Geen netto dipoolmoment
Soms kan er sprake zijn van polaire atoombindingen maar levert de som van de afzonderlijke dipoolmomenten toch een totaal dipoolmoment van nul op. We treffen dit bijvoorbeeld aan bij koolstofdioxide (CO2).
Omdat de bindingshoek in een CO2 molecuul 180° is (zie Binas-tabel 53B of ScienceData-tabel 8.8b) is het molecuul lineair. Dit houdt in dat beide afzonderlijke dipoolmomenten even groot maar tegengesteld van richting zijn. Het netto dipoolmoment is dus gelijk aan nul.
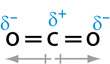
Afhankelijk van de ruimtelijke structuur kunnen sommige moleculen dus wel polaire atoombindingen bevatten maar toch geen netto dipoolmoment hebben.