Hoe werkt een batterij?
Eén van de belangrijkste toepassingen van elektrochemische cellen is als stroombron. In principe kan iedere elektrochemische cel dienst doen als stroombron. Enkele van de meest bekende worden hieronder besproken: de zink-koolbatterij en de kwikbatterij.
Zink-koolbatterij
De zink-koolbatterij (ook wel droge cel of zinkbruinsteenbatterij genoemd) is opgebouwd uit een omhulsel van zink dat dienst doet als de negatieve pool. Binnen in de batterij zit een (niet-reagerende) koolstofstaaf die dienst doet als positieve pool. De eigenlijke halfreactie van de oxidator is gebaseerd op de reactie tussen mangaan(IV)oxide (bruinsteen) en water. Als elektrolyt is een pasta van ammoniumchloride aanwezig.
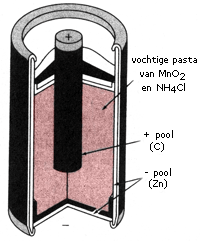
Voor de halfcel met de reductor geldt:
Zn (s)\(\rightleftarrows\)Zn2++2 e−
Voor de halfcel met de oxidator geldt:
2 MnO2 (s)+H2O (l)+2 e−\(\rightleftarrows\)Mn2O3 (s)+2 OH−
Er bestaat ook een basische versie van deze batterij. Als elektrolyt is hierbij een pasta van KOH of NaOH aanwezig. De halfreactie van de oxidator blijft hetzelfde. Zink reageert dan echter op de volgende wijze als reductor:
Zn (s)+2 OH−\(\rightleftarrows\)ZnO (s)+H2O (l)+2 e−
Kwikbatterij
De kwikbatterij wordt tegenwoordig, door de hogere milieu-eisen, niet meer gebruikt. Het omhulsel van zink doet ook hier dienst als negatieve pool. De positieve pool is van staal. Deze pool is in contact met een mengsel van kwik(II)oxide en kaliumhydroxide. Het kwik(II)oxide doet dienst als oxidator. Het kaliumhydroxide is aanwezig als elektrolyt.
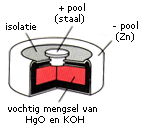
Voor de halfcel met de reductor geldt:
Zn (s)+2 OH−\(\rightleftarrows\)ZnO (s)+H2O (l)+2 e−
Voor de halfcel met de oxidator geldt:
HgO (s)+H2O (l)+2 e−\(\rightleftarrows\)Hg (l)+2 OH−