Hoe werkt een brandstofcel?
Een brandstofcel is een voorbeeld van een elektrochemische cel waarbij de reactanten continu worden toegevoegd. Terwijl accu's en batterijen na verloop van tijd leeg raken (en eventueel weer moeten worden opgeladen) is er bij de brandstofcel sprake van een continue stroomvoorziening. Het bekend voorbeeld van een brandstofcel is de zogenoemde knalgascel. In deze cel reageren zuurstof-en waterstofgas met elkaar.
De brandstofcel bevat twee poreuze koolstofelektrodes waarop een katalysator is aangebracht. Langs beide elektrodes wordt een gasstroom van zuurstof en waterstof geleid. Als verbindende elektrolyt is een mengsel van water en kaliumhydroxide. Het eindproduct van deze reactie, water, verlaat de brandstofcel in de vorm van stoom. Een versie van dit type cel werd gebruikt in de space shuttle.
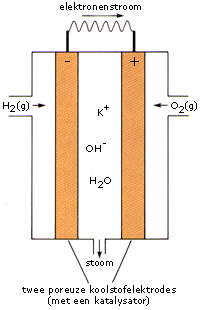
Voor de halfcel met de reductor geldt:
2 H2 (g)+4 OH−\(\rightleftarrows\)4 H2O+4 e−
Voor de halfcel met de oxidator geldt:
O2 (g)+2 H2O+4 e−\(\rightleftarrows\)4 OH−
In een brandstofcel worden de reactanten continu aangevoerd en de producten continu afgevoerd. Zo'n cel kan dus continu stroom leveren.