Hoe werkt een elektrochemische cel?
Tijdens een reactie tussen een oxidator en een reductor vindt er een overdracht van elektronen plaats. Als een redoxreactie wordt uitgevoerd in één oplossing dan worden de elektronen meteen overgedragen als de verschillende deeltjes met elkaar in contact komen. Op deze manier kan er dus niets nuttigs worden gedaan met de energie die een reactie levert. Hoe kunnen we nu deze energie het best benutten?
De oplossing is om zowel de oxidator als de reductor fysisch van elkaar te scheiden. Met andere woorden: niet de reactie uitvoeren in een oplossing die zowel de oxidator als de reductor bevat, maar in twee gescheiden ruimtes; de één met de oxidator, de ander met de reductor. Door beide ruimtes te verbinden met een geleidende draad zorg je ervoor dat de elektronenoverdracht van de redoxreactie door de draad zal plaatsvinden. Op deze manier kan je dan gebruik maken van de stroom van de elektronen.
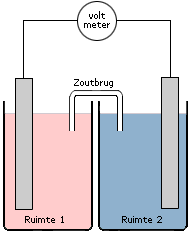
De elektronen zullen niet zomaar gaan stromen als beide ruimtes (ook wel halfcellen genoemd) met elkaar worden verbonden. Eén van de vereisten voor het starten van een redoxreactie is een gesloten stroomkring. Dit betekent dat beide halfcellen met elkaar verbonden dienen te worden zonder dat de inhoud met elkaar kan mengen. We doen dit door middel van een zoutbrug (een U-vormig buisje gevuld met een geleidende zoutoplossing) of een poreuze wand of membraan. Op deze wijze wordt direct contact tussen de oxidator en de reductor vermeden maar is er wel een geleidend contact tussen beide ruimtes. Zo'n systeem van twee halfcellen met in de één de oxidator en in de ander de reductor verbonden door middel van bijvoorbeeld een zoutbrug noemen we een elektrochemische cel.
De manier waarop er elektrische stroom gaat lopen in een elektrochemische cel kan in een aantal stappen worden onderverdeeld. We gaan uit van een elektrochemische cel die uit twee ruimtes bestaat: ruimte 1 bevat de sterkste reductor en ruimte 2 bevat de sterkste oxidator. In beide ruimtes bevindt zich een niet reagerende elektrode. De elektrodes zijn met elkaar verbonden. De ruimtes zijn verbonden door middel van een zoutbrug. Binnen de stroomkring is een voltmeter aangebracht (zie tekening boven).
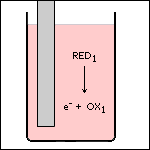 |
Stap 1 In ruimte 1 reageert de reductor (RED1). Hierbij ontstaat zijn geconjugeerde oxidator (OX1) en een elektron. |
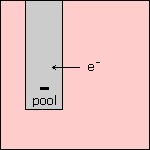 |
Stap 2 Het elektron wordt opgenomen door de elektrode. Doordat de elektrode elektronen opneemt, wordt deze negatief geladen. Met andere woorden: deze elektrode wordt de negatieve (-) pool. |
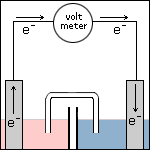 |
Stap 3 De elektronen gaan door de draad heen en verplaatsen zich van ruimte 1 naar ruimte 2. |
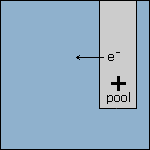 |
Stap 4 De elektronen worden door de elektrode in ruimte 2 afgegeven aan de vloeistof. Doordat de elektrode elektronen afstaat, wordt deze positief geladen. Met andere woorden: deze elektrode wordt de positieve (+) pool. |
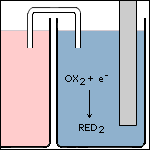 |
Stap 5 In ruimte 2 neemt de oxidator (OX2) het elektron op. Hierbij ontstaat zijn geconjugeerde reductor (RED2). |
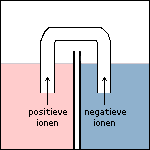 |
Stap 6 Doordat elektronen in ruimte 2 vrijkomen, zal deze ruimte na verloop van tijd steeds negatiever geladen worden. Ter compensatie hiervan (en om de stroomkring te sluiten) gaan kleine negatieve ionen via de zoutbrug van ruimte 2 naar ruimte 1 gaan. Andersom gaan kleine positieve ionen via de zoutbrug van ruimte 1 naar ruimte 2 gaan. De stroomkring is nu gesloten. |
Het is belangrijk om te zien dat voordat de reactie begint de beide elektrodes geen lading hebben. Ze worden pas positief en negatief geladen nadat de reactie op gang is gekomen.
Onthoud dat in een elektrochemische cel de sterkste oxidator altijd aan de (+)-pool reageert en de sterkste reductor altijd aan de (−)-pool.
Er zal pas een elektrische stroom gaan lopen als wordt voldaan aan de eis dat het verschil tussen de standaardelektrodepotentiaal van de oxidator en de standaardelektrodepotentiaal van de reductor meer dan 0,3 Volt bedraagt.