Wat is een zoutbrug?
Een elektrochemische cel bestaat in het algemeen uit twee gescheiden ruimtes; de één met de oxidator, de ander met de reductor. Door beide ruimtes te verbinden met een geleidende draad zorg je ervoor dat de elektronenoverdracht van de redoxreactie door de draad zal plaatsvinden. Op deze manier kun je dan gebruik maken van de stroom van de elektronen.
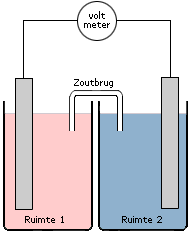
De elektronen zullen niet zomaar gaan stromen als beide ruimtes (ook wel halfcellen genoemd) met elkaar worden verbonden. Eén van de vereisten voor het starten van een redoxreactie is een gesloten stroomkring. Dit betekent dat beide halfcellen met elkaar verbonden dienen te worden zonder dat de inhoud met elkaar kan mengen. We doen dit door middel van een zoutbrug. Op deze wijze wordt direct contact tussen de oxidator en de reductor vermeden maar is er wel een geleidend contact tussen beide ruimtes.
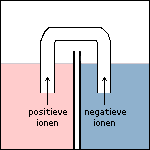
Een zoutbrug is vaak een U-vormig buisje gevuld met een geleidende zoutoplossing (vaak KCl) of een poreuze wand of membraan. In een eenvoudig experiment kan zelfs een in KCl gedrenkd filtreerpapiertje dienst doen als zoutbrug.
Wat is de functie van een zoutbrug in een cel?
Na verloop van tijd zal door het vrijkomen van elektronen één van de ruimtes van een cel negatiever geladen worden. Ter compensatie hiervan (en om de stroomkring te sluiten) zullen kleine negatieve ionen via de zoutbrug van deze ruimte naar de andere ruimte gaan. Andersom zullen kleine positieve ionen via de zoutbrug terugkomen.