Wat zijn de hoofd- en subniveaus in een elektronenwolk?
Elektronen bevinden zich in een atoom in een elektronenwolk rond de atoomkern. De elektronen bewegen niet willekeurig door de elektronenwolk. Ze zijn verdeeld over een aantal schillen (ook wel energieniveaus genoemd). De verdeling van de elektronen van een bepaald atoom over de beschikbare energieniveaus noemt men de elektronenconfiguratie.
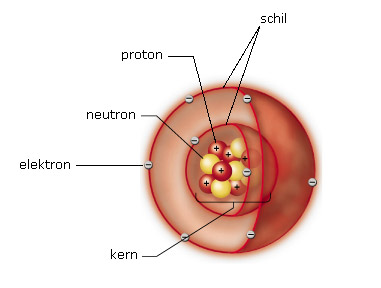
We maken een onderscheid tussen twee soorten energieniveaus: de hoofdniveaus en de subniveaus.
Hoofdniveau
Het aantal elektronen dat zich maximaal op een hoofdniveau kan bevinden, staat weergegeven in onderstaande tabel:
| nummer schil | 1 | 2 | 3 | 4 | ... |
|---|---|---|---|---|---|
| maximale aantal elektronen in de schil | 2 | 8 | 18 | 32 | ... |
Het nummer van een periode in het periodiek systeem komt overeen met het nummer van het aantal hoofdniveaus dat in gebruik is.
Let op: niet alle hoofdniveaus moeten maximaal gevuld zijn. Soms zitten elektronen al in een volgend hoofdniveau terwijl een vorig hoofdniveau nog niet maximaal gevuld is (zie het voorbeeld van kalium hieronder).
In Binas-tabel 99 of op het schutblad van ScienceData staat de vulling van de hoofdniveaus aangegeven bij de verschillende atoomsoorten (elektronenconfiguratie).
Voorbeeld
Zuurstof (O) heeft atoomnummer 8 en staat in periode 2 van het periodiek systeem. Het heeft dus 8 elektronen die verdeeld zijn over 2 hoofdniveaus. Hoofdniveau 1 bevat dan twee elektronen en hoofdniveau 2 zes elektronen.
Voorbeeld
Kalium (K) heeft atoomnummer 19 en staat in periode 4 van het periodiek systeem. Het heeft dus 19 elektronen die verdeeld zijn over 4 hoofdniveaus. Hoofdniveau 1 bevat dan twee elektronen, hoofdniveau 2 acht elektronen, hoofdniveau 3 acht elektronen (terwijl achttien het maximum is) en hoofdniveau 4 één elektron.
De verschillende hoofdniveaus worden soms aangeduid als K, L, M en N-schillen.
Subniveau
Met uitzondering van hoofdniveau 1 zijn alle andere hoofdniveaus onderverdeeld in verschillende subniveaus. Deze subniveaus worden aangeduid met de letters s, p, d en f. Hoeveel elektronen een subniveau maximaal kan bevatten staat weergegeven in onderstaande tabel:
| subniveau | s | p | d | f |
|---|---|---|---|---|
| maximale aantal elektronen in het subniveau | 2 | 6 | 10 | 14 |
Alle subniveaus verschillen onderling in energie. Het opvullen van de niveaus met elektronen gebeurd in volgorde van toenemende energie.
De eerste twee elektronen uit hoofdniveau 1 zullen zich alle twee bevinden in subniveau s. We geven dit aan als 1s2. De acht elektronen uit het tweede hoofdniveau zijn verdeeld over de subniveaus s en p: 2s2 2p6.
Voorbeeld
De verdeling van de 8 elektronen van zuurstof over de energieniveaus: 1s2 2s2 2p4
Voorbeeld
De verdeling van de 19 elektronen van kalium over de energieniveaus: 1s2 2s2 2p6 3s2 3p6 4s1
Periodiek systeem
De elementen in een bepaalde groep van het periodiek systeem hebben allemaal hetzelfde aantal elektronen in het hoogste gebruikte subniveau. Het laatst bijgeplaatste elektron bevindt zich steeds op een subniveau van hetzelfde type.
De elementen uit groep 1 (de alkalimetalen) hebben allemaal één elektron op een subniveau s. De aardalkalimetalen (groep 2) hebben allemaal twee elektronen op een subniveau s. Voor alle halogenen (groep 17) geldt dat ze vijf elektronen op een subniveau p hebben. De edelgassen (groep 18) hebben (op helium na) zes elektronen op een subniveau p.