Hoe is een atoom opgebouwd?
Een atoom is opgebouwd uit een positieve atoomkern bestaande uit protonen en neutronen met daar omheen een negatieve wolk van elektronen. De lading van de elektronenwolk is precies even groot als die van de atoomkern; het atoom is als geheel neutraal van lading.
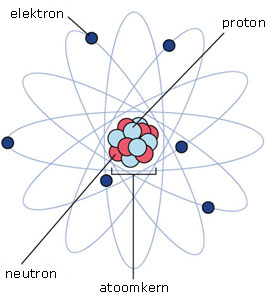
De atoomkern
De atoomkern is het centrum van een atoom en bestaat dus uit protonen en neutronen. De positieve lading van de kern wordt veroorzaakt door de protonen. Neutronen hebben geen lading.
De elektronenwolk
De elektronenwolk die zich rond om de atoomkern bevindt bestaat uit één of meerdere negatief geladen deeltjes: de elektronen. De elektronen zijn de belangrijkste deeltjes van een atoom: zij zorgen voor het vormen van chemische bindingen.
Omdat een atoom neutraal van lading is, is het aantal protonen in de kern gelijk aan het aantal elektronen in de elektronenwolk.
De elektronen cirkelen rond de atoomkern in banen met een verschillende diameter. We noemen deze banen ook wel schillen.
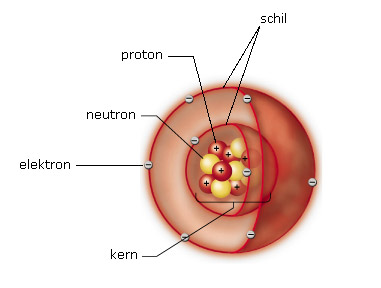 |
| Schematische weergave van een zuurstofatoom. Zuurstof bezit 8 protonen en 8 neutronen in de kern en heeft 8 elektronen verdeeld over twee schillen. |
Niet alle schillen bevatten evenveel elektronen. De elektronen in de buitenste schil zijn het belangrijkst. Deze elektronen zijn namelijk betrokken bij het vormen en verbreken van chemische bindingen tussen atomen. De elektronen in de buitenste schil worden ook wel de valentie-elektronen genoemd.
Het aantal elektronen dat een schil maximaal kan bevatten, staat weergegeven in onderstaande tabel:
| nummer schil | 1 | 2 | 3 | 4 | ... |
|---|---|---|---|---|---|
| max. aantal elektronen in de schil | 2 | 8 | 18 | 32 | ... |
Het nummer van een periode in het periodiek systeem komt overeen met het aantal schillen dat in gebruik is.
Voorbeeld
Zuurstof (O) heeft atoomnummer 8 en staat in periode 2 van het periodiek systeem. Het heeft dus 8 elektronen die verdeeld zijn over 2 schillen. Schil 1 bevat dan twee elektronen en schil 2 zes elektronen . De zes elektronen in de tweede schil zijn bij zuurstof de valentie-elektronen.
Meer informatie over de structuur van de elektronenwolk in hoofdniveaus (K, L, M en N) en subniveaus (s, p, d en f) vind je hier.
Atoomsoorten
Het aantal protonen in de atoomkern bepaalt met welk soort atoom we te maken hebben. Heeft een atoom bijvoorbeeld 7 protonen in de kern dan hebben we te maken met een stikstofatoom. Het aantal protonen van een atoom noemen we ook wel het atoomnummer. In Binas-tabel 99 of op het schutblad van ScienceData staan de atoomnummers van alle atomen weergegeven.
Voorbeeld
Boor heeft atoomnummer 5 en heeft dus 5 protonen.
De som van het aantal protonen en neutronen wordt het massagetal genoemd. De meeste atomen kunnen meerdere massagetallen hebben. Dit betekent dat het aantal neutronen in een atoomkern kan variëren. In Binas-tabel 25 of ScienceData-tabel 1.11 vind je de massagetallen van een groot aantal atoomsoorten.
Voorbeeld
Waterstof heeft atoomnummer 1. Dit betekent dat waterstof 1 proton heeft. Om te weten hoeveel neutronen waterstof heeft, kijken we naar het massagetal. In Binas-tabel 25 of ScienceData-tabel 1.11 vinden we dat waterstof drie verschillende massagetallen kan hebben. Heeft het massagetal 1 dan bevat het geen neutronen. Heeft het massagetal 2 dan bevat het één neutron. Heeft het massagetal 3 dan bevat het twee neutronen in de atoomkern.
Atomen met hetzelfde atoomnummer maar verschillende massagetallen noemen we isotopen.